چکیده
پس زمینه
گرچه چندین عامل درمانی برای درمان بیماری کورونا ویروس 2019 (Covid-19) مورد ارزیابی قرارگرفته است، اما هیچ یک از این عوامل موثر نبودهاند.
روشها
ما یک کارآزمایی دو سو کور، تصادفی، کنترلشده با دارونمای درون وریدی مربوط به رمدسیویر را در بزرگسالان بستریشده مبتلا به Covid-19 با شواهدی از درگیری دستگاه تنفسی تحتانی، انجام دادیم. بيماران بهطور تصادفی تعیین شدند كه يك بار رمدسیویر (مقدار (دوز) اولیه 200 میلیگرم در روز اول و به دنبال آن 100 میلیگرم در روز تا حداکثر 9 روز دیگر) يا دارونما تا 10 روز دریافت کنند. پیامد اولیه، زمان بهبودی بود که با ترخیص از بیمارستان یا بستری شدن برای کنترل عفونت، تعریف شد.
نتایج
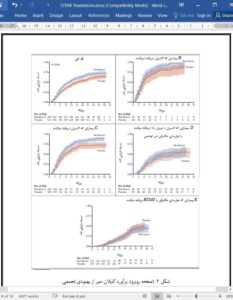
درکل 1063 بیمار به صورت تصادفی انتخاب شدند. هیئت نظارت بر داده¬ها و ایمنی، بر اساس یافتههای حاصل از تجزیه و تحلیل که مدت زمان کوتاهتر را برای بهبود در گروه رمدسیویر نشان میدهد، کورسازی نکردن (unblinding) اولیه را توصیه میکند. نتایج اولیه¬ی 1059 بیمار (مقرر شد که 538 نفر رمدسیویر و 521 دارونما دریافت کنند) همراه با دادههای موجود پس از تصادفیسازی نشان داد افرادی که رمدسیویر دریافت کردهاند دارای مدت زمان بهبودی 11 روز بودند (بازه اطمینان 95٪ [CI] ، 9 تا 12)، در مقایسه با 15 روز (بازه اطمینان95%، 13 تا 19) در افرادی که دارونما دریافت کرده بودند (نسبت سرعت برای بهبودی، 32/1؛ بازه اطمینان95٪ ، 1.12 تا 1.55؛ P <0.001). برآورد کاپلان–میر میزان مرگ در طی 14 روز 7.1% با رمدسیویر و 11.9% با دارونما بود (نسبت خطر مرگ، 70/0، بازه اطمینان 95٪، 47/0 تا 04/0). برای 114 مورد از 541 بیمار در گروه رمدسیویر که تحت تصادفیسازی قرار گرفتند (1/21٪) و 141 بیمار از 522 بیمار در گروه دارونما که تحت آمایش تصادفیسازی قرار گرفتند، پیامدهای نامطلوب رخ داد.
نتیجهگیری
رمدسیویر در كوتاه كردن زمان بهبودی در بزرگسالان بستری شده مبتلا به کووید-19 و شواهدی ازعفونت دستگاه تنفسی تحتانی، نسبت به دارونما بهتر بود. (تأمین مالی شده توسط موسسه ملی آلرژی و بیماریهای واگیردار ایالات متحده آمریکا و سایرین؛ شمارهACCT-1 ClinicalTrials.gov ،NCT04280705.) کرونا ویروس جدید، کروناویروس سندرم حاد تنفسی ۲ (SARS-CoV-2) ، برای اولین بار در دسامبر سال 2019 به عنوان علت بیماری تنفسی منتصب به بیماری کروناویروس 2019 یا Covid-19 شناخته شد. چندین عامل درمانی برای درمان Covid-19 مورد ارزیابی قرار گرفته است، اما هنوز هیچ یک از آنها موثر نبوده¬اند. رمدسیویر (GS-5734)، مهارکننده ویروسی وابسته به RNA است، RNA پلیمراز با فعالیت مهاری در برابر SARSCoV و سندرم تنفسی خاورمیانه (MERS-CoV)، در ابتدا به دلیل توانایی آن در مهار SARS-CoV-2 در شرایط آزمایشگاهی، به¬عنوان یک کاندید درمانی امیدوارکننده برایCovid-19 شناخته شد. علاوه بر این، در مطالعات پریماتهای (نخستیسانان) غیرانسانی، رمدسیویر 12 ساعت پس از تلقیح با MERS-CoVشروع به کاهش سطح ویروس ریه و آسیب ریه کرد.
برای ارزیابی اثربخشی بالینی و ایمنی عوامل درمانی تحقیقاتی فرضی در میان بزرگسالان بستری شده مبتلا به Covid- 19 که توسط آزمایشگاه تایید شدند، ما یک پلتفرم تطبیقپذیر برای انجام سریع آزمایشات فاز 3، تصادفی، دو سو کور و کنترل شده با دارونما طراحی کردیم. ما در اینجا نتایج اولیه مرحله اول کارآزمایی درمانی Covid-19تطبیقپذیر (ACTT-1) را شرح میدهیم، که در آن درمان با رمدسیویر را در مقایسه با دارونما ارزیابی کردیم.
روشها
طرح
ثبت نام برای ACTT-1 در 21 فوریه 2020 آغاز شد و در 19 آوریل 2020 به پایان رسید. 60 مکان و 13 مکان فرعی برای کارآزمایی وجود داشت، در ایالات متحده (45 مکان)، دانمارک (8)، انگلیس (5)، یونان (4)، آلمان (3)، کره (2)، مکزیک (2)، اسپانیا (2)، ژاپن (1) و سنگاپور (1). بیماران واجد شرایط به طور تصادفی به نسبت 1: 1 برای دریافت رمدسیویر یا دارونما تعیین شدند. تصادفیسازی با استفاده از مکان مطالعه و شدت بیماری در هنگام ثبت نام طبقهبندی شد (برای جزئیات بیشتر در مورد معیارهای طبقهبندی، به پیوست تکمیلی، که با متن کامل این مقاله در NEJM.org موجود است، مراجعه کنید). رمدسیویر به صورت درونوریدی به عنوان مقدار اولیه 200 میلیگرم در روز اول و به دنبال آن یک مقدار نگهدارنده 100 میلیگرم روزانه در روزهای 2 تا 10 یا تا زمان ترخیص از بیمارستان یا مرگ تزریق شد. دارونما مطابق با همان برنامه و در همان حجم داروی فعال، تزریق شد. به دلیل کمبود دارونمای متناظر، از دارونمای نرمال سالین در مکانهای اروپایی و برخی از مکانهای غیراروپایی استفاده شد؛ مواد تزریقی با یک کیسه مات و پوششهایی برای لوله، پوشانده شدند تا کورسازی حفظ شود. مطابق با استاندارد مراقبت از بيمارستان محل کارآزمایی، تمامی بيماران تحت مراقبت قرار گرفتند. اگر یک بیمارستان سیاست مکتوب یا دستورالعملی برای استفاده از سایر روشهای درمانی Covid-19 داشته باشد، بیماران میتوانند آن درمان را دریافت کنند. در صورت عدم وجود سیاست مکتوب یا دستورالعمل، سایر درمانهای تجربی یا استفاده از داروهای عرضه شده در بازار به عنوان درمان خاص برای درمان Covid-19 که هنوز تاییدیه نگرفتهاند از روز اول تا روز 29 ممنوع بود (اگرچه می توان قبل از ثبتنام در این کارآزمایی از چنین داروهایی استفاده کرد).
پروتکل آزمایشی در هر مکان توسط هیئت مدیره بررسی نهادی (یا توسط یک هیئت مدیره بررسی نهادی متمرکز در صورت لزوم) تصویب میشد و توسط یک هیئت نظارت بر دادهها و ایمنی مستقل نظارت میشد. رضایت آگاهانه از بیماران یا نماینده قانونی مورد تایید بیمار در صورتی که بیمار قادر به رضایت نبود، کسب شد. جزئیات کامل در مورد طرح کارآزمایی، اجرا، نظارت و تجزیه و تحلیل را میتوان در پروتکل و برنامه تحلیل آماری (موجود در NEJM.org) یافت.