چکیده
از جمله عوامل مهمی که در تنظیم تعادل واکنش اکسایش-کاهش کلروپلاست در پاسخ به تغییرات شدت نور نقشی اساسی ایفا می کنند عوامل اکساینده واسطه هستند و این کار را به وسیله فعالیت پراکسیداز وابسته به تیول در پروکسی ردوکسین سیستئین-2 انجام میدهند و برای انجام این عملکرد به تیوردوکسین ردوکتازوابسته به نیکوتین آمید آدنین دی نوکلئوتید فسفات نیاز دارند. علاوه بر این، کلروپلاست های گیاهی مجهز به گلوتاتیون پراکسیدازها ،پراکسیدازهایی تیول دار هستند که به تیوردوکسین ها متکی هستند .اگرچه عوامل اکساینده واسطه گلوتاتیون پراکسیدازها دارای یک مکانیزم واکنشی مشابه با پروکسی ردوکسین سیستئین-2هستند اما هنوز نقش آنها درهموستازی اکسایش-کاهش کلروپلاست زیاد مشخص نیست .به منظوربررسی این موضوع ، ما بروی گیاه آرابیدوپسیس تحقیق کرده ایم که دارای دو جهش گلوتاتیون پراکسید1، گلوتاتیون پراکسید7 بود و فاقد دو گلوتاتیون پراکسیداز 1 و 7 مستقر در کلروپلاست بود. علاوه بر این، برای تجزیه و تحلیل رابطه عملکردی گلوتاتیون پراکسیدازهای کلروپلاست با سیستم اکسیداسیون و کاهش پروکسی ردوکسین سیستئین-2- تیوردوکسین ردوکتازجهش های گلوتاتیون پراکسید1، گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2و گلوتاتیون پراکسید1گلوتاتیون پراکسید7-تیوردوکسین ردوکتازایجاد شدند.جهش گلوتاتیون پراکسید1،گلوتاتیون پراکسید7 فنوتیپ نوع وحشی را نشان می دهد که اثبات کننده این است که گلوتاتیون پراکسیدازهای کلروپلاست برای حداقل رشد گیاه تحت شرایط استاندارد ضروری هستن .با این حال،جهش- گلوتاتیون پراکسید1 گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2رشد کندتری نسبت به جهش شپرون پروتئینی متصل غشایی2 نشان داد .فقدان همزمان پروکسی ردوکسین سیستئین-2و گلوتاتیون پراکسیداز بر عملکرد محتوای کلروفیل و عملکرد فتوسیستم2تأثیر گذاشت و باعث تاخیر بیشتر در اکسیداسیون آنزیم در تاریکی شد.در مقابل جهش-گلوتاتیون پراکسید-1گلوتاتیون پراکسید7-تیوردوکسین ردوکتاز، با ترکیب کردن فقدان تیوردوکسین ردوکتازو گلوتاتیون پراکسیدازهای کلروپلاست مانند جهش تیوردوکسین ردوکتاز رفتار می کنند که نشان می دهد سهم گلوتاتیون پراکسیدازهادر هم ایستایی واکنش اکسایش-کاهش کلروپلاست مستقل از تیوردوکسین ردوکتازاست.سنجش های آزمایشگاهی به بررسی بیشتر این نظریه پرداختند و نشان دادند که فرایند کاهش توسط تیوردوکسین ردوکتاز اتفاق نمی افتد، بلکه کاهش به وسیله تیوردوکسین y2 رخ میدهد.بر اساس این نتایج، ما نقشی را برای گلوتاتیون پراکسیدازها در توالی اکسایش-کاهش کلروپلاست ارائه دادیم .
2- مواد و روشها
2-1-مواد زیستی(بیولوژیکی) و شرایط رشد
نوع وحشی گیاه آرابیدوپسیس تالیانا (اکوتیپ کلمبیا) و گیاهان جهش یافته روی خاک در بسترهای کشت به ترتیب تحت دوره های دوره نوری روز بلند (16 ساعت روشنایی - 8 ساعت تاریکی) یا روز کوتاه (8 ساعت روشنایی - 16 ساعت تاریکی) با شدت نور120 (پیکولوکس نور ورودی بر مترمربع 2- بر ثانیه 1-) و رطوبت نسبی 70 درصد قرار گرفتند. برای تیمارهای نور زیاد گیاهانی که تحت دوره نوری روز کوتاه به مدت 6 هفته رشد کرده بودند با شدت نور 800 (پیکولوکس نور ورودی بر مترمربع 2- بر ثانیه 1-))در معرض نور قرار گرفتند. سویه های اشریشیا کلای در ماده مغذی میلر مایع در دمای 37 درجه سانتیگراد با آنتی بیوتیک مناسب رشد داده شدند.
2-2- توالی جهش های دوگانه، سه گانه و چهارگانه گیاه آرابیدوپسیس
برای تولید جهش دوگانه گلوتاتیون پراکسید1،گلوتاتیون پراکسید7،تک جهش گلوتاتیون پراکسید1 (SALK_027373) و گلوتاتیون پراکسید7(SALK_072007)که از مرکز ذخیره آرابیدوپسیس اروپایی (دردانشگاه ناتینگهام، انگلستان) به دست آمده بود، به صورت دستی ترکیب شدند و جهش دوگانه گلوتاتیون پراکسید1، گلوتاتیون پراکسید7 از نتاج با آنالیز جایگذاری آگروباکتریوم تومافاسین حامل-دی ان ای در ژنوم دی ان ای با استفاده از الیگونوکلئوتیدهای نشان داده شده در جدول S1ایجاد شد.جهش چهارگانه گلوتاتیون پراکسید1، گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2 و جهش سه گانه گلوتاتیون پراکسید7- تیوردوکسین ردوکتاز به ترتیب با تلاقی دستی جهش گلوتاتیون پراکسید7- که در بالاشرح داده شد با جهش شپرون پروتئینی متصل غشایی2]41 [و جهش تیوردوکسین ردوکتاز ] 45 [ایجاد شدند.جهش های گلوتاتیون پراکسید1، گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2 و جهش سه گانه گلوتاتیون پراکسید7- تیوردوکسین ردوکتاز از فرزندان این تلاقی ها با تجزیه و تحلیل حضور درج های دی ان ای منتقل شده در دی ان ای ژنومی با الیگونوکلئوتیدهای نشان داده شده در جدول S1 انتخاب شدند.
2-3- استخراج پروتئین، سنجش آلکیلاسیون و تجزیه و تحلیل وسترن بلات
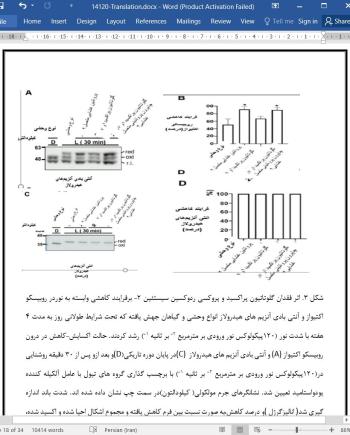
بافت برگ ها جدا شد و بلافاصله با نیتروژن مایع منجمد شد. عصاره های پروتئینی با بافر استخراجی تهیه شدند ( 50 میلی مولار تریس هیدروکلراید، 15/0مولار نمک ، 5/0 درصد محلول شوینده غیریونی و غیر دناتوره کننده نانیدیت ، که بلافاصله به بافت های برگ که تحت نیتروژن مایع قرار داشتند اضافه شد که بعد از چرخش برروی دستگاه ورتکس آزمایشگاه عصاره ها در 100/16گرم در دمای 4 درجه سانتیگراد به مدت 20 دقیقه سانتریفیوژ شدند. پروتئین با استفاده از معرف برادفورد اندازه گیری شد.سنجش آلکیلاسیون طبق تحقیقات قبلی [46] با استفاده از60 میلی مولار یدواستامید انجام شد.برای آنالیز سدیم دودسیل سولفات-پلی آکریل آمید الکتروفورز ژل نمونه های پروتئین تحت شرایط احیاکننده یا غیر احیاکننده قرار گرفتند همانطور که در شکل نشان داده شده است از غلظت ژل آکریل آمید 9.5درصد برای روبیسکو اکتیواز و آنزیم های هیدرولازیا 12درصد برای تیوردوکسین ردوکتاز،پراکسیردوکسین های سیستئین-2 و گلوتاتیون پراکسیدازها ،استفاده شد.پروتئین های جدا شده به غشاهای نیتروسلولزی منتقل شدند و به همراه آنتی بادی مشخص شده مورد بررسی قرار گرفتند. آنتی بادی های اختصاصی برای تیوردوکسین ردوکتاز[45] و پراکسیردوکسین های سیستئین-2 [38] قبلاً در آزمایشگاه تولید شده بودند. آنتی بادی ضد روبیسکو اکتیواز توسط دکتر پورتیس(وزارت کشاورزی ایالات متحده آمریکا) و آنتی بادی آنزیم های هیدرولاز و گلوتاتیون پراکسیدازها از تولیدکننده آنتی بادی گیاهی و جلبکی سوئدی خریداری شد.